Informativo
Técnico Nº. 265
Medicamentos
e medicações
no controle de doenças entéricas pós-desmame
Autor/s. : Ton Kramer, Médico-veterinário, Gerente Comercial de Suínos.
Introdução
Nos
últimos 40 anos, a suinocultura brasileira passou por grandes
transformações.
Manejo, instalações, nutrição,
genética e sanidade evoluíram de tal forma que
há alguns anos o Brasil tornou-se referência na
produção de suínos. Com o
aumento da própria produção e da produtividade, os
desafios sanitários
cresceram proporcionalmente, resultado da intensificação
e da concentração da
produção em determinadas regiões do país.
Decorrente disso e da busca
inconstante pelos melhores resultados zootécnicos e financeiros,
o uso de
promotores de crescimento e aditivos alimentares passou a ser rotineiro.
A
eleição do medicamento ou programa medicamentoso vai
depender
do agente etiológico envolvido e a fase que acomete o animal

O
início dos anos 2000 foi marcado pelos crescentes casos de circovirose
e das doenças associadas. Durante esse período, entre as
diversas medidas de
manejo adotadas no intuito de minimizar os prejuízos, como os
reconhecidos 20
Pontos de Madec, o uso de programas
medicamentosos,
alternando pulsos antibióticos com períodos de uso
contínuo, foi uma estratégia
positiva no sentido de frear o impacto negativo da síndrome.
Com
o advento das diversas opções de vacinas contra a circovirose
e a melhoria nas práticas de manejo, os desafios
sanitários diminuíram e, por consequência,
o uso dos programas medicamentosos.
No
entanto, ao longo de todo esse período, a pressão
econômica promoveu alguns
abusos no uso de medicamentos, especialmente antibióticos, que,
por vezes,
foram utilizados em subdosagens por
períodos menores
ao prescrito pelo médico-veterinário ou recomendado pelo
laboratório
farmacêutico, ou, ainda, pelo uso de drogas-padrão como matériaprima.
Do
outro lado da cadeia de produção, o consumidor passou a
ser cada vez mais
exigente. Da mesma forma, e uma vez que o Brasil passou a ser um
importante
exportador de carne suína, os países importadores
passaram a ser mais
exigentes. Como resultado disto, restrições foram
impostas ao uso de
medicamentos. Some-se a isso, ainda, uma preocupação cada
vez maior da área
médica no que diz respeito às resistências
bacterianas e as discussões ainda
inconclusivas da importância que a produção animal
tem neste processo,
decorrente do uso dos aditivos alimentares melhoradores
de desempenho.

Em
1986, o Ministério da Agricultura brasileiro lançou o
Plano Nacional de
Controle de Resíduos (Portaria n° 51, de 6 de fevereiro de
1986). Como resultado deste plano, em 1999 foram
lançados os Programas
de Controle de Resíduos em Carne (Portaria n° 42, de 20 de
dezembro de 1999).
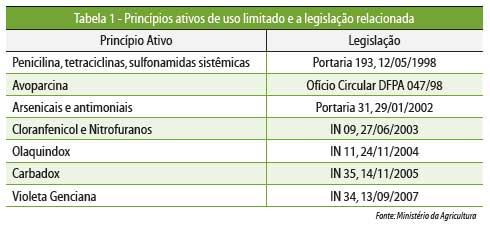
Paralelamente, foi restringido ao longo dos anos o uso de alguns
princípios
ativos, relacionados na Tabela 1.
Mais
recentemente, outras instruções normativas foram
publicadas no sentido de
normatizar e regular a importação,
fabricação, comercialização e uso de
medicamentos, sendo:
- Instrução Normativa nº
13, de 30 de novembro de 2004: aprova o regulamento técnico
sobre aditivos para produtos destinados à
alimentação animal;
- Instrução Normativa nº
65, de 21 de novembro de 2006: aprova os
procedimentos para a fabricação e o emprego de
rações, suplementos, premixes,
núcleos ou concentrados com medicamentos para os animais de
produção;
- Instrução Normativa nº
04, de 23 de fevereiro de 2007: aprova o regulamento técnico
sobre as condições higiênico- sanitárias e
de boas práticas de fabricação para
estabelecimentos fabricantes de produtos destinados à
alimentação animal e o roteiro de inspeção;
- Instrução Normativa SDA
nº 29, de 14 de junho de 2007: aprova os procedimentos para a
importação de produtos destinados à
alimentação animal;
Além disso,
está em discussão o Relatório Técnico do
Grupo de
Trabalho instituído pela Portaria SDA nº 428, de 10 de
dezembro de 2009, que
"sugere descontinuidade do uso como aditivo melhorador
de desempenho por preocupações relacionadas à
saúde pública" (Ofício nº
087/2011/DFIP, de 10 de maio de 2011), especialmente, em
relação à segurança
toxicológica, os princípios ativos clorexidina,
halquinol, e em relação ao
desenvolvimento de resistência
bacteriana, os princípios ativos espiramicina,
eritromicina, tiamulina,
lincomicina e colistina.
Todas
essas ações têm como intuito ou consequência:
- Definir os princípios ativos
passíveis de uso em medicina veterinária e que não
resultem em possível resistência bacteriana a medicamentos
de uso na medicina humana;
- Garantir origem, qualidade e destino dos
aditivos e medicamentos utilizados na produção animal;
- Valorizar o profissional da área
médica veterinária no sentido de prescrever e recomendar
o uso de medicamentos com base em um diagnóstico;
- Diferenciar o uso dos antibióticos
como terapêuticos e aditivos melhoradores
de desempenho.
Princípios
gerais no uso de antibióticos
O
uso de um antibiótico na produção animal tem
objetivos que vão além do simples
tratamento de uma infecção ou desafio bacteriano (Tabela
2).
Figura 1 - Princípios
da escolha do antibiótico
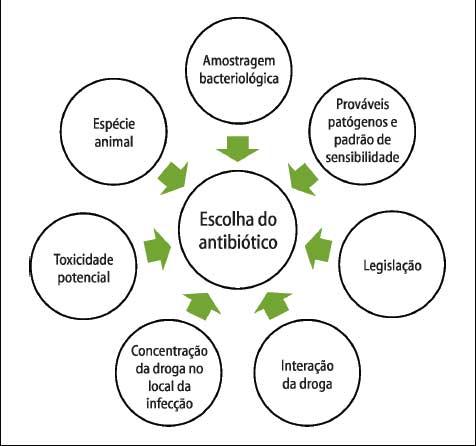
A
escolha de um medicamento ou programa medicamentoso depende das
informações
disponíveis no momento. No entanto, devem-se levar em
consideração os aspectos
da Figura 1.
Os tratamentos
antibióticos
Estando
determinados os contextos clínico, econômico e
sanitário e tendo o diagnóstico
definido, pode-se estabelecer o tratamento a ser realizado.
De
maneira geral, os tratamentos antibióticos podem ser diferenciados
em terapêutico (ou curativo) e profilático (ou
preventivo).
Um
tratamento antibiótico terapêutico é normalmente
administrado para um grupo de
animais que apresentem os sinais clínicos da doença, ou
em todo o lote, quando
houver a expectativa de que outros animais possam desenvolver a
infecção. O
objetivo deste tipo de tratamento é eliminar o microrganismo
causador da
infecção, seja de manifestação
clínica, subclínica ou
assintomática.
O
tratamento profilático (ou preventivo), por sua vez, é
normalmente utilizado
quando há uma grande probabilidade da infecção
bacteriana no lote, e o
tratamento terapêutico, por sua vez, no caso da
manifestação clínica, é difícil
ou de custo mais elevado.
Em
uma visão médica, os tratamentos terapêuticos
deveriam ser os de preferência,
especialmente aqueles direcionados especificamente aos animais
acometidos pela
infecção. Isto porque o uso preventivo é o
primeiro passo para o uso
sistemático, prática que pode ser negativa, uma vez que
pode levar ao
desenvolvimento de resistência bacteriana e é normalmente implementado
para compensar um mau manejo sanitário da granja.
Os
princípios ativos e seus usos
O
termo antibiótico (do grego anti =
contra e bio = vida) foi inicialmente
empregado
para definir substâncias químicas produzidas por
microrganismos que têm a
capacidade de, em pequenas doses, inibir o crescimento ou destruir
microrganismos causadores de doenças. Posteriormente, houve
necessidade de
ampliar este conceito, pois se tornou possível obtê-los
por síntese laboratorial
parcial (antibióticos semissintéticos
ou biossintéticos) ou total (sintobióticos)
(SPINOSA et al, 2005).
Os
antibióticos podem ser classificados segundo:
- Estrutura química / Grupo
farmacológico
- Origem / Síntese
- Ação biológica
- Espectro de ação
- Mecanismo de ação
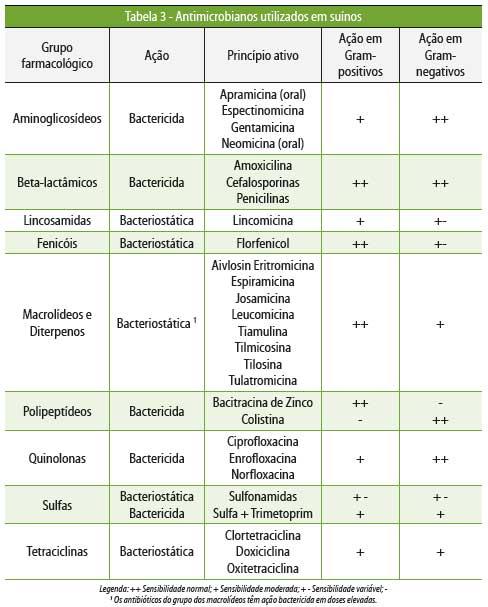
A
Tabela 3 relaciona os principais antibióticos utilizados na
suinocultura
brasileira e sua classificação.
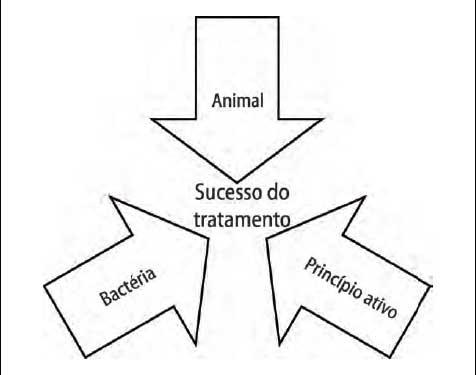
Considerando
que o sucesso do tratamento antibiótico é uma consequência
da relação "Animal - Bactéria - Princípio
ativo" (Figura 2), quando
da escolha de um antibiótico ou associação de
antibióticos, deve-se
preferencialmente conhecer o agente etiológico da doença.
Quando isso não é
possível, a escolha do medicamento a ser utilizado deve
considerar o quadro
clínico, achados de necropsia, epidemiológicos e
laboratoriais, localização do
processo infeccioso e idade dos animais acometidos.
É
importante ressaltar que os antibióticos nunca eliminam a
população bacteriana
em sua totalidade: o crescimento bacteriano é simplesmente
interrompido (efeito
bacteriostático) ou a população bacteriana
é reduzida a um nível mínimo (efeito
bactericida). É sempre o sistema imune do indivíduo que
promove a completa
eliminação da população bacteriana.
Figura 2 - Tríade de
envolvidos no tratamento
medicamentoso
A
análise da atividade antibacteriana deve considerar, em um
primeiro momento, o
espectro de ação do medicamento e a
concentração inibitória mínima (CIM) para a
bactéria que se quer combater. Na sequência,
é
necessário compreender as características
farmacocinéticas: o perfil
farmacocinético para o tipo de processo infeccioso e a CIM do
antibiótico nos
tecidos, uma vez que cada princípio ativo e tecido tem um
comportamento
diferente (Figura 4 e Tabelas 4 e 5).
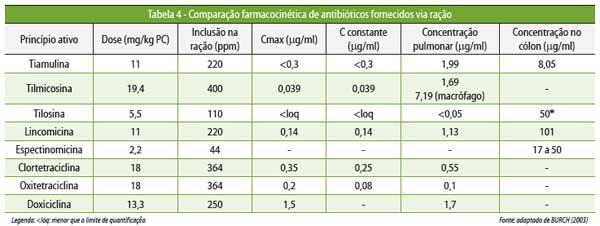
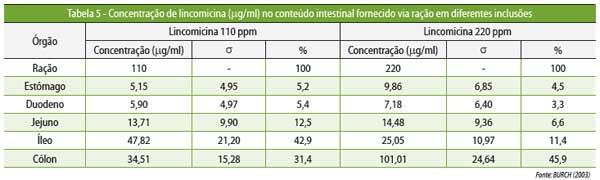
Quando
um antibiótico é administrado em um animal, a
concentração do princípio ativo
alcançada depende da farmacocinética (metabolismo do
animal). Os processos de
absorção, distribuição e
eliminação determinam o perfil farmacocinético de
um
antibiótico (Figura 3).
Para
agir nos órgãos-alvo, o antibiótico deve ingressar
na circulação (absorção)
para então ser transferido pelo corpo
(distribuição). Uma vez na circulação, o
comportamento do antibiótico é o mesmo, independentemente
da via de administração.
No
entanto, a via de administração tem relação
direta para o tempo que o
medicamento leva para alcançar a concentração
máxima no órgão-alvo.
Considerando que na suinocultura as principais vias de
administração de
medicamentos são injetáveis, via ração e
água de bebida, de acordo com o
desafio apresentado, uma via terá preferência em
relação às demais. A Tabela 6
faz um comparativo entre as vantagens e desvantagens de cada via.
Não
há uma via de administração de medicamentos
única e ideal. Para cada infecção,
uma via de administração será preferencial. Devem
ser considerados, para tanto,
os recursos disponíveis, tanto de mão de obra quanto
equipamento, e as
condições clínica dos animais. Além disso,
independentemente da via de
administração utilizada para o tratamento, é
fundamental que as doses
recomendas pelo fabricante do medicamento ou pela literatura
científica sejam
respeitadas. O termo dosagem refere-se não somente à dose
diária individual de
cada produto (normalmente expressa em mg
de princípio ativo/kg de peso corporal), mas também ao
regime de administração
(duração do tratamento e intervalo entre as
aplicações).
A
dosagem utilizada de um antibiótico deve ser suficiente para
reduzir a
população bacteriana de tal forma que o sistema imune
possa agir no sentido de
eliminar a infecção. De acordo com a farmacologia
clássica, a dosagem ideal é
aquela que garante uma concentração nos tecidos
mantém-se superior à CIM da
bactéria, durante todo o período de tratamento. Em casos
em que há necessidade
de um tratamento com antibióticos de ação
bactericida, os objetivos de
concentração são muito mais altos que a CIM,
devendo superar a concentração
bactericida mínima (CBM).
Figura 3 - Perfil
farmacocinético de um
antibiótico administrado por diferentes vias
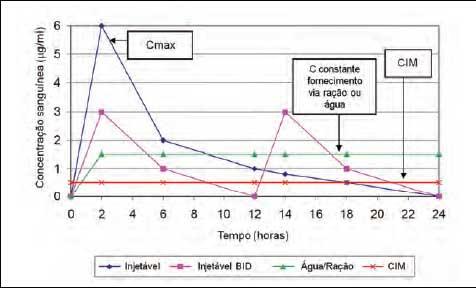
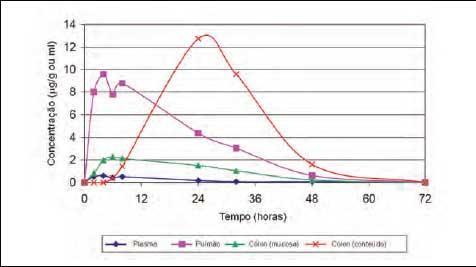
Figura 4 - Concentração
de tiamulina
no plasma, pulmão e cólon, após a
aplicação injetável na dose de 15 mg/kg de peso
corporal (McKELLAR, 1993, citado por BURCH,
2003)
A
dosagem indicada pelo laboratório farmacêutico normalmente
corresponde com
aquela que é efetiva para o tratamento indicado
e aprovada
pelos órgãos reguladores competentes. No entanto,
essa dosagem não pode
ser fixa, pelas diversas razões relacionadas com a farmacologia.
O
médico-veterinário deve ser capaz de adaptar a dosagem,
se necessário, com base
nas informações e dados disponíveis: CIM,
concentração nos tecidos, modo de
ação dose ou tempo-dependente, disponibilidade de
princípios ativos, etc.
Outro
ponto fundamental a ser considerado no que diz respeito às
dosagens tem a ver
com a administração do medicamento, principalmente via
ração, quando
normalmente as indicações estão descritas em ppm, ou seja,
relacionadas com a inclusão do produto
na ração, sem levar em consideração a
variação de consumo ao longo da vida do
animal.
A
Tabela 7 mostra a dose diária e a inclusão na
ração recomendada para um
medicamento, como a tiamulina, cuja dose
é 10 mg/kg,
e com uma apresentação
comercial a 80%.
Combinação
de antibióticos
A
combinação de antibióticos tem como objetivo
aumentar a atividade antibiótica
dos princípios ativos quando comparados aos mesmos se usados
individualmente,
pela sinergia entre eles ou pelo aumento do espectro de
ação.
Além
disso, a associação de antibióticos pode ter a
finalidade de evitar a
possibilidade de resistência ou para atingir diferentes locais de
infecção.
É
importante analisar o efeito da combinação antes de
empregá-la. Os efeitos da
associação podem ser:
- Sinérgica: quando ocorre a potencialização do efeito esperado
dos medicamentos. Nesse caso, o efeito final é maior do que a
soma dos efeitos de cada antibiótico;
- Antagônico: quando o efeito obtido
é menor do que o esperado para cada um dos antibióticos
ou, ainda, há efeito tóxico;
- Indiferente: quando o efeito dos
antibióticos é independente, como se cada um deles
estivesse sendo utilizado isoladamente.
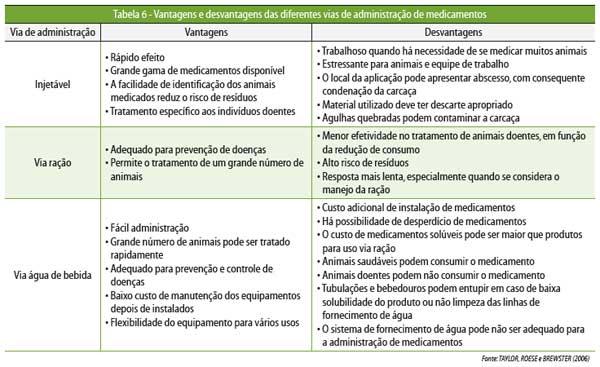
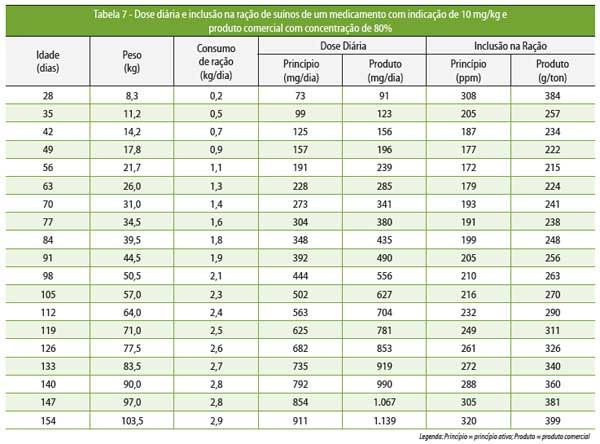
Figura 5 - Possíveis
efeitos da associação de
antibióticos (SMITH e JAWETZ, 1972)

As
regras gerais de associação de antibióticos foram
descritas por JAWETZ (1967),
e são ainda válidas - Figura 5 (normalmente, a
associação entre antibióticos
bacteriostáticos e bactericidas está relacionada à
fase do crescimento
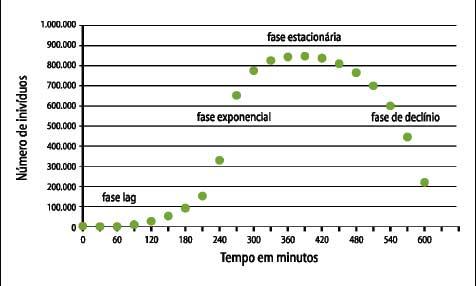
bacteriano - Figura 6):
- Combinação de dois
antibióticos bactericidas: pode ter uma ação
sinérgica; é frequentemente
indiferente;
- Combinação de dois
antibióticos bacteriostáticos: normalmente indiferente;
- Combinação de um
antibiótico bacteriostático com um bactericida cuja
ação se dá na fase lag/de
latência (aminoglicosídeos, colistina e fluoroquinolonas):
normalmente indiferença;
- Combinação de um
antibiótico bacteriostático com um bactericida cuja
ação se dá na fase exponencial/de
multiplicação (beta-lactâmicos):
normalmente antagonismo.
É
importante ressaltar que estas regras têm exceções
relacionadas aos
microrganismos e aos órgãos acometidos.
Figura 6 - Padrão de
crescimento bacteriano em um
sistema fechado
Antibiogramas como
ferramenta de escolha do melhor tratamento
Embora
o conceito e a técnica da realização de
antibiogramas sejam bastante simples,
observam-se no dia a dia dificuldades na
interpretação
e uso dos dados obtidos por esta análise.
O
antibiograma tem relevância no processo de escolha de um
tratamento antibiótico
quando:
- O tempo gasto para a
execução do exame laboratorial e a obtenção
do resultado é compatível com a evolução da
doença;
- O exame laboratorial reflete a
situação do campo.
Para
tanto, a amostra de material utilizada para a realização
do antibiograma deve
ser patologicamente representativa, compatível com a
história clínica da doença
e sem fatores que possam interferir negativamente no resultado do exame.
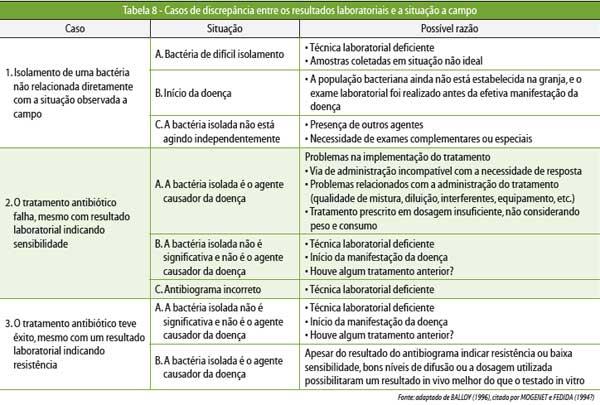
A
Tabela 8 mostra os casos de discrepância entre os resultados
laboratoriais e a
realidade a campo.
Resistência
bacteriana
Define-se
como resistência bacteriana a situação em que
é impossível obter-se a CIM. A consequência
disto é a falha no tratamento. No entanto, não
necessariamente a falha no tratamento seja sinônimo
de
resistência bacteriana.
O
desenvolvimento de resistência bacteriana, além de
determinar menor eficácia da
droga, também representa um potencial de risco à
saúde pública, uma vez que o
contato dos homens com os animais pode aumentar a ocorrência de
resistência da microbiota desta
espécie (BONGERS et
al, 1995, citado por
BACCARO et al,
2002).
A
resistência bacteriana pode ser:
- Intrínseca ou Natural: quando a
bactéria é naturalmente resistente a determinado
princípio ativo;
- Adquirida: quando a bactéria sofre
uma mutação genética, que a permite sobreviver ou
resistir na presença de uma concentração de
antibiótico superior ao usual. Essa mutação pode
ser resultado de uma alteração cromossômica ou extracromossômica (plasmídeo
ou transposon);
- Fenotípica ou Antibiotípica:
quando uma cepa bacteriana é resistente a um grupo
antibiótico.
A
ocorrência de resistência bacteriana está
relacionada com a prática rotineira
de administração de tratamentos antibióticos via
oral, especialmente quando em subdosagens
ou por períodos menores do que o recomendado.
Além disso, mudanças frequentes
de moléculas, sem a
avaliação da sensibilidade bacteriana, ou, ainda, a
mistura de diferentes
antibióticos e a subdosagem
são excelentes meios de
promover o desenvolvimento da resistência bacteriana.
As subdosagens resultam em
concentrações baixas do princípio
ativo no organismo do animal, que não são suficientes
para inibir ou promover a
eliminação bacteriana. Essa prática é
bastante comum, especialmente quando não
são considerados o peso e o consumo dos animais que estão
sendo tratados
(Tabela 7) e, muitas vezes, está relacionada com o alto custo do
medicamento
utilizado.
O
controle do desenvolvimento de resistência está
relacionado com o uso racional
de medicamentos e a implementação
de medidas efetivas
de melhoria da situação sanitária da granja.
Neste
sentido, são ferramentas para o
controle do
desenvolvimento da resistência o controle sanitário da
granja, com exames
bacteriológicos rotineiros e a análise dos riscos
clínico e epidemiológico, bem
como melhorias nas práticas de limpeza e
desinfecção e a adoção de programas
vacinais.
Quando
da adoção de tratamentos antibióticos, eles devem
ser rápidos, a fim de limitar
o desenvolvimento bacteriano, respeitando doses e tempo de
administração de
cada princípio ativo.
Os principais
desafios entéricos na fase de creche
As
doenças entéricas representam um problema importante na
suinocultura
tecnificada, devido às grandes perdas econômicas
associadas com estas
patologias. Os problemas decorrentes das diarreias
em
suínos são consequências
dos gastos com antibióticos,
aumento da mortalidade, necessidade de manejo, cuidados com os animais
doentes
e conversão alimentar inadequada (ZLOTOWSKI et al, 2008).
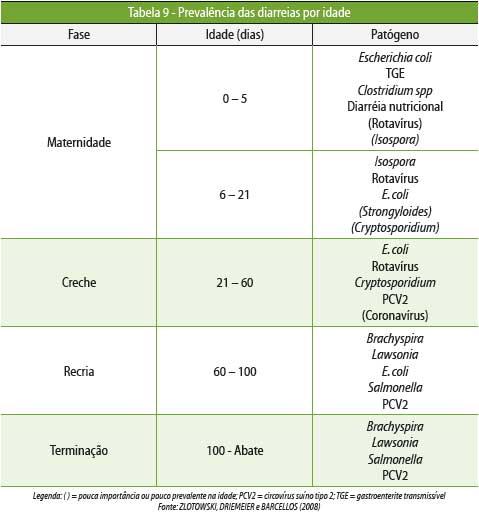
A
Tabela 9 apresenta as causas de diarreias
dos suínos
e a fase em que ocorrem mais frequentemente.
Especificamente
na fase de creche, a E. coli mantém como
um importante
agente causador de enterite. Sua infecção é de
difícil controle devido à
elevada capacidade deste agente em desenvolver e disseminar mecanismos
de
resistência aos antimicrobianos utilizados no tratamento da
doença.
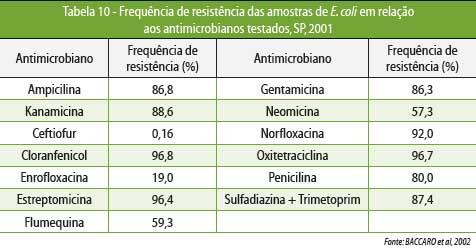
BACCARO
et al
(2002), estudando 600 amostras de E. coli isoladas de fezes de 100
leitões
lactentes, com diarreia e idade variando
entre 5 e 30
dias, demonstraram que todas as amostras estudadas apresentaram
resistência a
pelo menos 5 dos 13 antimicrobianos testados. A Tabela 10 mostra a frequência de resistência observada
nesse trabalho.
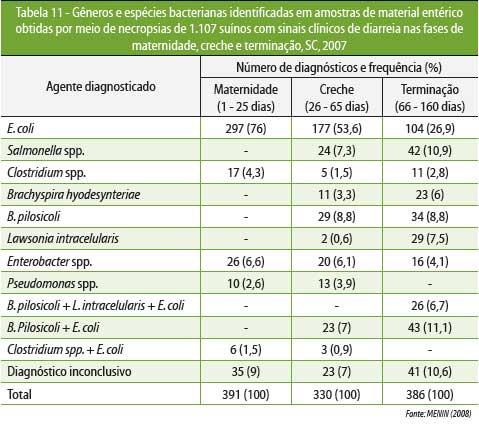
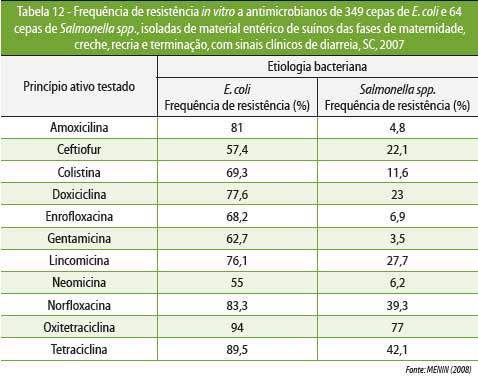
MENIN
et al
(2008) determinaram os agentes bacterianos associados com
ocorrência de diarreias em
suínos, em diferentes faixas etárias, em Santa
Catarina (Tabela 11), e também verificaram o perfil de
resistência de E. coli
e Salmonella
spp. frente aos
principais
antimicrobianos utilizados em granjas de suínos (Tabela 12).
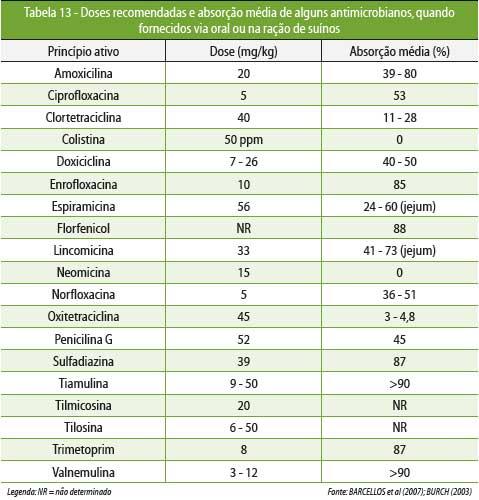
A
Tabela 13 relaciona doses preconizadas e absorção
média de alguns
antimicrobianos.
Independentemente
da fase e, como já mencionado anteriormente, as medidas de
controle, tratamento
e prevenção de doenças devem estar relacionadas
com o uso racional dos
antibióticos, associadas às boas práticas de
limpeza e desinfecção, programas
de vacinação adequados aos desafios da granja e
monitoramentos frequentes do status
sanitários da granja.
Possíveis
causas de falha no tratamento antibiótico
A
função do médico-veterinário na
assistência à granja não pode se limitar
somente à prescrição do tratamento. Cabe a ele,
também, determinar possíveis
causas do insucesso do tratamento. Apesar de muitas vezes atribuir-se a
culpa
da falha no tratamento antibiótico à resistência
bacteriana, há várias outras
possíveis causas que devem ser consideradas.
Entre
as possíveis causas que levam ao insucesso de um tratamento
antibiótico, estão
incluídas:
- Diagnóstico incorreto ou incompleto
- Erros relacionados à etiologia da
doença: causa não infecciosa, outro agente infeccioso,
etiologia multifatorial;
- Interpretação incorreta do
antibiograma (Tabela 8).
- Implementação incorreta do tratamento antibiótico
- Erro de dosagem;
- Instabilidade do tratamento;
- Problemas de mistura ou
solubilização do medicamento;
- Consumo insuficiente.
- Ineficácia do antibiótico no
animal
- Antibiótico não indicado
para o microrganismo;
- Iteração medicamentosa;
- O antibiótico não atinge o
órgão-alvo;
- CIM muito alta e/ou
concentração do antibiótico
muito baixa;
- Imunossupressão.
As
causas de falha nos tratamentos podem estar relacionadas com
questões clínicas,
bacteriológicas e até econômicas. É
fundamental que o médico-veterinário e os
profissionais envolvidos estejam atentos a possíveis causas de
insucesso nos
tratamentos.
Conclusão
O
uso de antibióticos na produção animal
sofrerá cada vez mais pressão da opinião
pública, exigindo que órgãos como o
Ministério da Agricultura sejam mais
exigentes no sentido de limitar e controlar o uso deste tipo de
medicamento.
Além
disso, a própria pressão decorrente da resistência
bacteriana exigirá mais
critério no uso de programas antibióticos por parte de
médicos-veterinários,
produtores e empresas.
No
entanto, o uso dos antimicrobianos sempre existirá e será
necessário para
garantir o sucesso na produção animal.
Por
tanto, o uso racional de antibióticos, vacinas, programas de
limpeza e
vacinação e controles sanitários fazem-se cada vez
mais necessários e
indispensáveis.
